艾兰宁 帕利哌酮缓释片 说明书
请仔细阅读药品说明书并按说明使用或在医师指导下购买和使用
药品名称
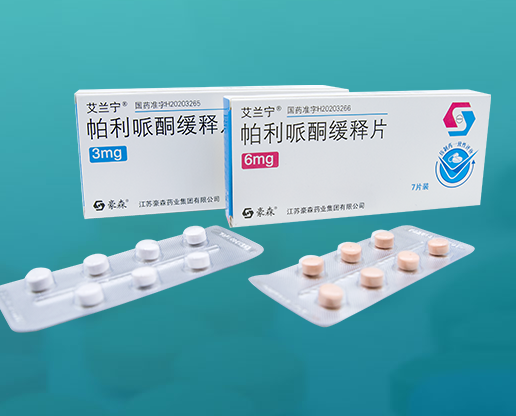
艾兰宁 帕利哌酮缓释片
通用名称
帕利哌酮缓释片
英文名称
PaliperidoneExtended-Release Tablets
汉语拼音
Palipaitong Huanshi Pian
主要成份
帕利哌酮
适应症
帕利哌酮缓释片适用于成人及12-17岁青少年(体重≥29Kg)精神分裂症的治疗。
性状
本品为白色或类白色薄膜衣片(3mg规格)或橘红色薄膜衣片(6mg规格),除去包衣后片芯为双层,一面显白色,一面显红色。
规格
14片
用法用量
成人:本品推荐剂量为6mg,一日一次,早上服用。 12-17岁青少年(体重≥29Kg):本品推荐剂量为3mg,一日一次,早上服用。 其余具体详见说明书。请仔细阅读说明书,或遵医嘱。
不良反应
以下不良反应会在说明书的其他部分进行更为详细的讨论(参见[注意事项]): •会增高痴呆相关性精神病老年患者的死亡率 •脑血管不良反应,包括中风(见于痴呆相关性精神病老年患者) •恶性综合征 •QT间期延长 •迟发性运动障碍 •高血糖和糖尿病 •高催乳素血症 •胃肠梗阻的可能性 •直立性低血压和晕厥 •可能的认知和运动功能障碍 •惊厥发作 •吞咽困难 •自杀 •阴茎异常勃起 •血栓性血小板减少性紫癜(TTP) •体温调节功能破坏 •止吐作用 •帕金森病或存在路易体痴呆患者的敏感性增高 •影响代谢或血液动力学反应的疾病或病症 临床试验中最常见的不良反应(在任何剂量组中,接受本品治疗受试者的报告率需
禁忌
已经在接受利培酮和帕利哌酮治疗的患者中观察到了超敏反应,包括速发过敏反应和血管性水肿。本品(帕利哌酮)属于利培酮的代谢产物,因此禁用于已知对帕利哌酮、利培酮或本品中的任何成分过敏的患者。
注意事项
老年痴呆相关精神障碍患者死亡率升高 与安慰剂相比,使用非典型性抗精神病药物治疗的痴呆相关性精神病老年患者的死亡危险性会增高。本品未批准用于治疗痴呆相关性精神病。 脑血管不良反应,包括中风,痴呆相关性精神病老年患者 在使用利培酮、阿立哌唑和奥氮平对老年痴呆受试者进行的安慰剂对照试验中,出现脑血管不良反应(脑血管意外和一过性缺血发作)的发生率高于接受安慰剂治疗的受试者,包括死亡。研究进行时,本品还没有上市。本品未批准用于治疗痴呆相关性精神病患者。 恶性综合征 已有报告指出,使用包括帕利哌酮在内的抗精神病药物的患者出现过具有死亡可能的综合征,即恶性综合征(NMS)。NMS的临床表现为高热、肌肉强直、意识状态改变以及自主神经紊乱(脉搏或血压不规律、心动过速、出汗和心律失常)。其他体征还可能包括血肌酸磷酸激酶水平升高、肌红蛋白尿(横纹肌溶解)和急性肾衰。 出现该综合征患者的诊断评价较为复杂。诊断时重要的一点是鉴别那些临床表现同时涉及严重医学疾病(如肺炎、全身感染等)和未经过治疗或未充分治疗的锥体外系体征和症状(EPS)的病例。其他在鉴别诊断需要重点考虑的事项包括:中枢抗胆碱能毒性、中暑、药物热和主要的中枢神经系统组织病理学检查。 NMS的处理应包括: 立即停止使用抗精神病药物和其他对目前治疗不重要的药物; 给予强化对症治疗和医学监测; 在特殊治疗能够实施的条件下,对任何合并的严重医学问题进行治疗。对于不复杂的NMS,目前还没有一致的特异性药理学治疗方案。 如果患者显示在NMS康复后需要抗精神病药物治疗,可重新引入药物治疗,但需要密切监测,因为已经报告出现NMS复发情况。 QT间期延长 帕利哌酮会引起一定程度的校正QT(QTc)间期延长。帕利哌酮使用时应避免与其他已知会延长QTc的药物联合使用,包括1A类(如奎尼丁、普鲁卡因胺)或III类(如胺碘酮、索他洛尔)抗心律失常药、抗精神病药物(如氯丙嗪、甲硫达嗪)、抗生素(如加替沙星、莫西沙星),或其他类型已知会延长QTc间期的药物。同时应避免在存在先天性QT间期延长综合征的患者中以及具有心律不齐病史的患者中使用帕利哌酮。 特定环境可能会增加与延长QTc间期药物使用相关的扭转型室性心动过速和/或猝死的发生危险,包括: 心动过缓; 低血钾或低镁血症; 合并使用其他可延长QTc间期的药物; 存在先天性QT间期延长。 在成年精神分裂症患者和分裂情感性障碍患者中进行的一项双盲、活性药物-对照物(单剂莫西沙星400mg)、多中心QT研究中就帕利哌酮对QT间期的作用进行了评价,另在三项于成年精神分裂症患者中进行的安慰剂和活性药物-对照物6周、固定剂量疗效试验中进行了研究。 在QT研究(n=141)中,8mg剂量的速释口服帕利哌酮片(n=50)组,第8天用药后1.5小时,QTcLD与基线差值比安慰剂组高12.3msec(90%CI:8.9;15.6)。8mg速释帕利哌酮平均的稳态峰血浆浓度较使用推荐的本品最大12mg剂量时观察到的暴露量高出两倍多(在进食标准早餐情况下给药时,Cmax ss分别是113ng/mL和45ng/mL)。在同一研究中,4mg剂量的速释口服帕利哌酮片(Cmax ss=35ng/mL)组,第2天用药后1.5小时,QTcLD与基线差值比安慰剂组高6.8msec(90%CI:3.6;10.1)。研究中,任何时间没有任何受试者的改变超过60ms或QTcLD超过500ms。 在三项固定剂量的疗效研究中,不同时间点的心电图(ECG)检查显示,只有一位本品12mg治疗组的受试者在第6天的一个时间点出现了超过60ms的改变(增加了62ms)。在这三项研究中,任何时间均无接受本品的受试者出现QTcLD超过500ms。 迟发性运动障碍和锥体外系症状 接受抗精神病药物治疗的患者可能会出现表现为潜在不可逆、不自主的运动障碍的综合征。虽然该综合征的发病率在老年人中最高,尤其是老年妇女,但仍无法具体预测哪些患者会发生该综合征。不同的抗精神病药物诱发迟发性运动障碍的可能是否有所不同仍不清楚。 发生迟发性运动障碍的危险性以及出现不可逆反应的可能性显示会随着治疗时间以及所给予患者抗精神病药物累积剂量的增加而增高,但该综合征也可能在以较低剂量、相对较短的治疗期后出现,不过不常见。 虽然停用抗精神病药物之后会部分或完全缓解该综合征,但对于确定的迟发性运动障碍还没有明确的治疗方法。抗精神病药物治疗本身会抑制(或部分抑制)该综合征的体征和症状,因此可能掩盖潜在的过程。症状抑制对该综合征的长期病程的影响还不清楚。 基于上述考虑,应以一种最可能将迟发性运动障碍发生率降至最低的方式处方使用本品。长期抗精神病药物治疗通常适用于已知对抗精神病药物治疗有效的慢性患者。对于确实需要长期治疗的患者,应寻找能够产生满意临床反应的最小剂量和最短治疗时间。应定期重新评价是否需要继续治疗。 如果接受本品治疗的患者出现迟发性运动障碍的体征和症状,则应考虑停止使用药物。不过,某些患者虽然出现该综合征也可能仍需要继续接受本品治疗。 锥体外系症状和精神兴奋药 同时接受精神兴奋药(如哌甲酯)和帕利哌酮治疗的患者应谨慎,因为在对其中一种或两种药物进行调整的过程中可能会出现锥体外系症状。应考虑逐步停用其中的一种或两种药物(参见[药物相互作用])。 高血糖和糖尿病 在使用所有非典型抗精神病药物治疗的患者中,已经报告某些特殊病例以及与酮症酸中毒或高渗性昏迷或死亡相关的病例中出现高血糖和糖尿病。多数情况下,这些病例见于上市后临床使用以及流行病学研究中,临床试验中较少见。高血糖、糖尿病和糖尿病恶化已在本品治疗使用中有过报道。而且,根据糖尿病在精神分裂症患者中发生危险增加的可能性以及糖尿病在普通人群中发生率的增加来评价非典型抗精神病药物使用和血糖异常之间的关系比较复杂。基于这些因素,目前还未能全面地了解非典型抗精神病药物使用和高血糖相关性不良事件之间的关系。不过,流行病学研究提示,接受非典型抗精神病药物治疗的患者发生治疗期间高血糖相关性不良事件的危险性增高。由于这些研究进行时本品还没有上市,因此还不清楚本品是否与危险性增高相关。 糖尿病确诊患者在开始非典型抗精神病药物治疗时应给予定期监测,防止血糖控制恶化。对于存在糖尿病危险因素的患者(如肥胖、糖尿病家族史),在开始非典型抗精神病药物治疗时应在治疗开始时检测空腹血糖,并在治疗期间定期检测。任何接受非典型抗精神病药物治疗的患者都应监测是否出现高血糖的症状,包括烦渴、多饮、多尿、多食和无力。对于在使用非典型抗精神病药物治疗期间出现高血糖症状的患者,应检测空腹血糖。某些情况下,停止使用非典型抗精神病药物会缓解高血糖,但是,某些患者停止使用可疑药物后可能仍然需要继续抗糖尿病治疗。 对青少年(12-17岁)精神分裂症受试者进行的安慰剂对照、6周研究获得的数据见表9a。 血脂异常 在接受非典型抗精神病药物治疗的患者中观察到血脂出现一些不良的变化。 对青少年(12-17岁)精神分裂症受试者进行的安慰剂对照、6周研究获得的数据见表9b。 体重增加 非典型抗精神病药物使用中已经观察到了体重增加。推荐在临床使用时监测体重。 一项6周、双盲、安慰剂对照研究以及本品暴露时间中位数为182天的开放性扩展研究对青少年精神分裂症受试者的体重增加情况进行了评估。青少年受试者(12-17岁)安慰剂对照、6周研究中的体重平均变化和体重增加≥7%(参见[临床试验])的受试者占比数据见表10。 在该开放性、长期研究中,接受本品治疗的全部受试者中体重较基线增加≥7%的受试者占比是33%。在评价使用本品治疗的青少年患者的体重增加情况时,应考虑身体正常增长预计带来的体重增加。当考虑开放性研究中本品的中位暴露时间(182天)以及根据年龄和性别预计的正常体重增量时,相对于常模数据的标准化分数评估可提供更具临床意义的体重变化值。体重标准化分数从开放性基线到研究终点的平均变化为0.1(高于常模数据中位数4%)。根据与常模数据进行的对比,认为这些变化无临床意义。 高催乳素血症 与其他多巴胺D2受体拮抗类药物类似,帕利哌酮会增高催乳素水平,而且增高会在长期给药过程中持续存在。帕利哌酮具有与利培酮(该药较其他抗精神病药物具有较高的催乳素增高作用)类似的催乳素增高作用。 无论病因如何,高催乳素血症均可能抑制下丘脑GnRH,从而导致垂体促性腺激素分泌减少。因此可能通过减少女性和男性患者性腺类固醇生成进而抑制生殖功能。在接受可致催乳素增高类化合物治疗的患者中已经报告出现溢乳、闭经、男性乳腺发育和阳痿。与性腺发育不全相关的长期高催乳素血症可能导致女性和男性骨密度下降。 组织培养试验显示,大约三分之一的人乳腺癌在体外具有催乳素依赖性,因此,在对先前检测到乳腺癌的患者开具该类药物的处方时,这是一个具有潜在意义的考虑因素。在小鼠和大鼠中进行的利培酮致癌性研究中,观察到脑下垂体、乳腺和胰岛细胞性肿瘤(乳腺癌、脑下垂体和胰腺腺瘤)的发生率增高。到目前为止进行的临床研究和流行病学研究均未显示长期使用该类药物与人类肿瘤发生之间具有关联,但数据仍非常有限,无法得出确定结论。 胃肠梗阻的可能性 因为本品的片剂不会变形,在胃肠道中形状也不会发生明显变化,因此本品通常不能用于先前存在严重胃肠道狭窄的患者(病理性或医源性,如食管动力障碍、小肠炎性疾病、粘连或运送时间缩短导致的“短肠”综合征、既往腹膜炎病史、囊性纤维化、慢性假性肠阻塞或Meckel憩室)。有罕见报道消化道狭窄患者服用不变形的缓释制剂出现梗阻症状。因为采用了缓释设计剂型,本品只能用于能够吞咽整片药物的患者(参见[用法用量])。 预期运送时间缩短,如腹泻时观察到的,会降低生物利用度,而运送时间延长,如胃肠道神经病变、糖尿病性胃轻瘫或其他原因时观察到的,预期会增高生物利用度。而当运送时间改变出现在上消化道时,更可能发生生物利用度改变。 直立性低血压和晕厥 在某些患者中,帕利哌酮会通过其α阻断作用诱导产生直立性低血压和晕厥。在对三项安慰剂对照、6周固定剂量试验结果汇总后发现,接受本品(3mg,6mg,9mg,12mg)治疗的患者报告晕厥的发生率为0.8%(7/850),相比之下,接受安慰剂的患者为0.3%(1/355)。在已知存在心血管疾病(如心力衰竭、心肌梗死或缺血病史、传导异常)或脑血管疾病以及易出现低血压(如脱水、低血容量和接受抗高血压药物治疗)的患者中慎用本品。在易发低血压的患者中应考虑监测体位性生命体征。 白细胞减少症、中性粒细胞减少症和粒细胞缺乏症 白细胞减少症、中性粒细胞减少症和粒细胞缺乏症的事件在抗精神病药物中已经有了报道,包括本品。粒细胞缺乏症的上市后报告十分罕见(<1/10,000)。 在治疗最初几个月需对有临床意义的白细胞降低或药物引起的白细胞减少症/中性粒细胞减少症病史的患者进行监测,如没有其他因素导致的情况下,出现有临床意义的白细胞下降的第一时间即应考虑停止使用本品。 对有临床意义的中性粒细胞减少症的患者应仔细监测发热或其他感染症状或体征,如果这些症状或体征发生应迅速进行治疗。有严重中性粒细胞减少症的患者(绝对白细胞计数<1×109/L)应停止服用本品并继续监测白细胞计数直至恢复正常。 静脉血栓栓塞 抗精神病药物有过静脉血栓栓塞(VTE)的案例报告。由于应用抗精神病治疗药物治疗的患者经常存在获得性的VTE风险因素,所以在使用本品治疗之前或期间应对所有VTE的可能危险因素进行确定并采取预防措施。 可能的认知和运动功能障碍 接受本品治疗的受试者中报告出现了嗜睡和镇静反应(参见[不良反应])。包括本品在内的抗精神病药物有可能影响患者判断、思考或运动技能。在进行一些需要心理状态改变的活动时,如操作危险的机器或骑电动车时,除非合理地确定帕利哌酮治疗不会产生不良影响,否则患者都应小心。 惊厥发作 在上市前临床试验中(三项安慰剂对照、6周固定剂量研究和一项于老年精神分裂症受试者中进行的研究),接受本品(3mg,6mg,9mg,12mg)治疗的受试者中0.22%的受试者出现惊厥发作,接受安慰剂治疗受试者的发生率为0.25%。与其他抗精神病药物类似,存在惊厥发作病史或其他可能降低惊厥发作阈值病症的患者中应小心使用本品。在年龄为65岁或更老患者中,降低惊厥发作阈值的病症可能更为常见。 吞咽困难 食道运动功能障碍和误吸可能与抗精神病药物的使用有关。其中吸入性肺炎是晚期阿尔茨海默型痴呆患者发病和死亡的一个常见原因。存在发生吸入性肺炎危险的患者中应慎用本品和其他抗精神病药物。 自杀 企图自杀的可能性在精神性疾病患者中本身既存在,在药物治疗期间,应对高危患者给予密切监测。本品处方用量应使用可达到良好的患者管理的最小片剂数量,减少药物过量发生危险。 阴茎异常勃起 具有α肾上腺受体阻断效应的药物据报道有可能诱发阴茎异常勃起。在本品的上市后监测中报告了阴茎异常勃起(参见[不良反应])。 血栓性血小板减少性紫癜(TTP) 在使用帕利哌酮进行临床研究期间未观察到出现TTP病例。虽然已经报告与利培酮给药相关的TTP病例,但与利培酮治疗的关系仍不清楚。 体温调节 抗精神病药可破坏身体降低中心体温的能力。如果患者处于可能导致中心体温升高的情况下,如高强度锻炼、暴露于极度高热条件下、合并使用抗胆碱药或脱水时,建议在处方使用本品时要适当注意。 止吐作用 在帕利哌酮临床前研究中观察到其具有止吐作用。这一作用如果在人体出现,应注意可能会掩盖一些药物过量,或例如肠阻塞、雷亥综合征、脑肿瘤的症状和体征。 术中虹膜松弛综合征 在白内障手术中发现某些药物的肾上腺能α1a受体拮抗作用可引起术中虹膜松弛综合征,例如本品。 术中虹膜松弛综合征可能会增加术中和术后的眼部并发症。如正在或既往使用了具有肾上腺能α1a受体拮抗作用的药物,应该在手术前告知眼外科医师。在白内障手术前停止α1阻断治疗的潜在利益尚未确定,必须权衡获益和停用抗精神病药物的风险。 伴随疾病患者中的使用 本品在具有某些伴随疾病的患者中使用的临床经验仍很有限(参见[药理毒理])。 已经报告帕金森病或存在路易体痴呆患者对抗精神病药物的敏感性增高。敏感性增高的具体表现包括:意识模糊、迟钝、体位不稳伴随频繁跌倒、锥体外系症状,临床特征与恶性综合征一致。 尚未在新近具有心肌梗死或不稳定型心脏病病史的患者中对本品进行广泛程度的评价及使用。确诊存在该类疾病的患者被排除在上市前临床试验中。由于使用本品具有发生直立性低血压的危险,因此在已知存在心血管疾病的患者中应小心使用(参见[注意事项])。 实验室检查 无推荐的特异性实验室检查。 管制药品 本品不属于管制药品。 药物滥用 还没有在动物或人中对帕利哌酮的滥用可能进行系统的研究。也无法确切地预测一旦上市,中枢神经系统作用性药物被误用、转化和/或滥用的程度。因此,对于具有药物滥用病史的患者应认真评估,对于对本品存在误用或滥用体征(如出现耐药性、剂量增高、觅药行为)的患者应给予密切观察。 药物依赖 还没有在动物或人中对帕利哌酮的耐受或物理依赖性的潜能进行系统的研究。 肾损害患者 必须根据患者肾功能情况进行个体化的剂量调整(参见[用法用量])。 肝损害患者 轻中度肝损害患者无需进行剂量调整。未在严重肝损害患者中对本品进行研究。请置于儿童不易拿到处。
药物相互作用
本品对其他药物的影响 考虑到帕利哌酮主要的中枢神经系统作用(参见[不良反应]),本品应小心与其他中枢作用性药物和酒精联合使用。帕利哌酮会拮抗左旋多巴和其他多巴胺激动剂的作用。 由于这些潜在的作用会诱导产生直立性低血压,因此在本品与其他具有该作用的治疗药物一同使用时可能会出现累积效应(参见[注意事项])。 当帕利哌酮和其他由CYP450同工酶代谢的药物合用时,并不预期会发生具有临床显著性意义的药代动力学相互作用。在人肝微粒体进行的体外研究显示,帕利哌酮不会明显抑制经过细胞色素CYP450同功酶包括CYP1A
贮藏
密封
包装
盒
有效期
24月
批准文号
国药准字H20203265
生产企业
江苏豪森药业集团有限公司